马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
本帖最后由 小方 于 2022-5-23 11:43 编辑 ' J5 S6 P: z8 ?# `1 h$ w O8 p
) T% ]& y9 V/ h9 z
一、靶点介绍
& ^+ B h9 D' \7 I( vCD39是腺苷生成途径的关键酶,可诱导细胞外的腺苷三磷酸(adenosine triphosphate,ATP)去磷酸化生成腺苷二磷酸(adenosine diphosphate,ADP),再将ADP去磷酸化生成腺苷一磷酸(adenosine monophosphate,AMP)。
- S$ K$ w1 W/ x: |8 e, X5 `
0 X: U% e% H- {( [& s+ }CD39表达增强导致肿瘤发生发展的机制包括促进肿瘤生长、血管生成、肿瘤转移和化疗耐药等,抑制或阻断CD39的表达能够减少肿瘤转移,增强抗肿瘤免疫治疗效果。
, ?$ ]/ D( U& B3 {! Q! t3 q1 c: m" \# u4 H$ a: l5 k
细胞外腺苷由应激或损伤的细胞释放,也可以经胞外酶CD39和CD73共同作用于胞外腺嘌呤核苷酸产生。腺苷在肿瘤免疫逃逸过程中发挥重要作用,肿瘤微环境中能够检测出高水平的腺苷,靶向腺苷生成通路或腺苷受体的治疗策略可以减弱免疫抑制,有效抑制肿瘤生长。因此,针对CD39介导的腺苷信号通路的免疫治疗可作为抗肿瘤免疫治疗的新方向。[1]
, G0 _+ J1 b, N3 q) E0 Z4 j0 y: G! E0 e) t/ G3 ?5 S8 e
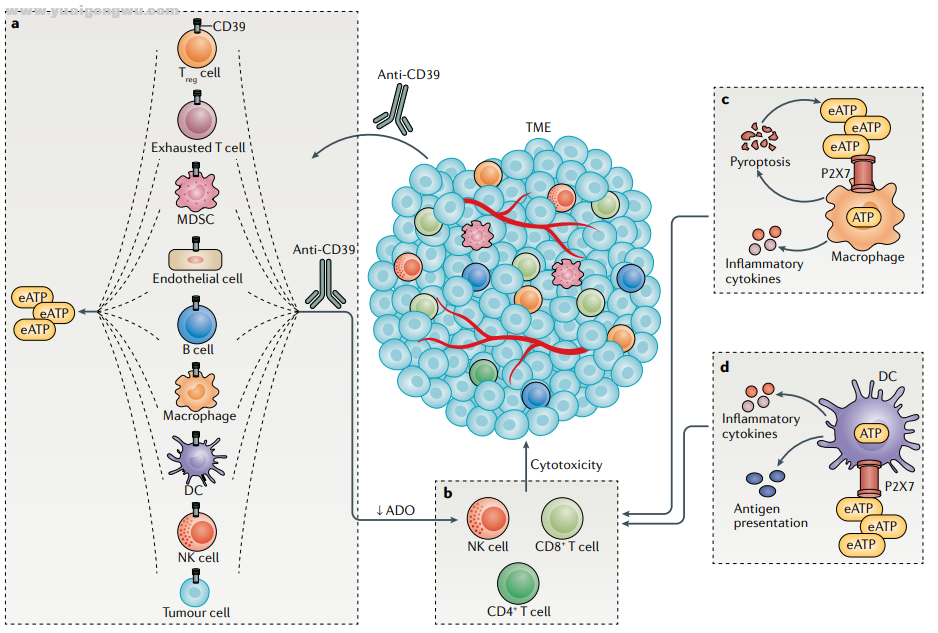 # y9 N& o5 t, Q$ J3 f. s图1 靶点机制[2]
# y9 N& o5 t, Q$ J3 f. s图1 靶点机制[2] |
|
|
|
|
|
|
共2条精彩回复,最后回复于 2022-5-23 11:44

尚未签到
本帖最后由 小方 于 2022-5-23 14:42 编辑
6 ~, o5 l$ K3 D* W& U9 i
: \. z/ i+ q) Z- k0 l1 a, H. ^- v二、可用药物 ! c" h" G3 k* p' a% j5 P+ e; a
目前,已有多种CD39抑制剂已进入临床试验阶段,包括TTX-030、IPH5201、SRF617等。其中,研究表明IPH5201能够增加ATP诱导的奥沙利铂的抗肿瘤活性,并证实了其与ICI和化疗药物联合应用在恶性肿瘤治疗中的潜力。
- W! x7 D! L( N( [9 i+ s# |: S1 S6 h$ ^( y" d! u
针对CD39的治疗机制主要是阻断腺苷的产生,另一种治疗策略则是直接阻断腺苷与其受体结合。A2AR抑制剂的临床数据表明这些药物具有良好的耐受性,且显示出一定的应用潜力。3种A2AR抑制剂目前正在Ⅰ/Ⅱ期临床试验中作为单一药物用于治疗实体瘤患者,分别是 CPI444 (NCT02655822)、AZD4635(NCT02740985)和NIR178 (NCT02403193、NCT03207867)。 |
|
|
|
|
|
|

尚未签到
|
三、参考文献
% N9 V0 l Y3 d. m, G[1]肖文华,孙荣丽.CD39/CD73及其介导的腺苷信号通路在肺癌免疫调控中的作用及研究进展[J].癌症进展,2022,20(01):12-17.- H, J! V) E: c9 } y6 j9 b
[2]Moesta, A. K., Li, X.-Y., & Smyth, M. J. (2020). Targeting CD39 in cancer. Nature Reviews Immunology. doi:10.1038/s41577-020-0376-4 |
|
|
|
|
|
|